111명이 접속하고 34개의 질문이 쏟아진 8월 12일 ‘OTC 모노그래프 사용자 수수료 프로그램’ 웨비나는 그만큼 열기가 뜨거웠다. 이는 미국 시장이 작년에 18% 성장하는 등 기업들의 미국 실무가 많아졌고 좀 더 디테일한 수출시 주의사항에 대한 관심이 높아졌다는 반증이다. 대한화장품협회가 주관한 이번 웨비나는 FDA 전문컨설턴트인 존 권(John Kwon)이 강의를 맡았다.
111명이 접속하고 34개의 질문이 쏟아진 8월 12일 ‘OTC 모노그래프 사용자 수수료 프로그램’ 웨비나는 그만큼 열기가 뜨거웠다. 이는 미국 시장이 작년에 18% 성장하는 등 기업들의 미국 실무가 많아졌고 좀 더 디테일한 수출시 주의사항에 대한 관심이 높아졌다는 반증이다. 대한화장품협회가 주관한 이번 웨비나는 FDA 전문컨설턴트인 존 권(John Kwon)이 강의를 맡았다. 미국에서는 화장품이면서 동시에 의약품인 경우는 OTC에 해당한다. 예를 들어 샴푸는 화장품이지만 비듬방지 치료제는 의약품이므로 ‘비듬방지 샴푸’는 화장품이면서 의약품이다. 존권 대표는 "브랜드사는 화장품 전성분 확인을 통해 일반 또는 OTC 제품인지 판단하고, OTC인경우 제조사가 업체 등록 및 OMUFA 시설 수수료 납부 완료된 상태인지 확인 후 제품 등록을 진행해야 한다"고 조언했다.
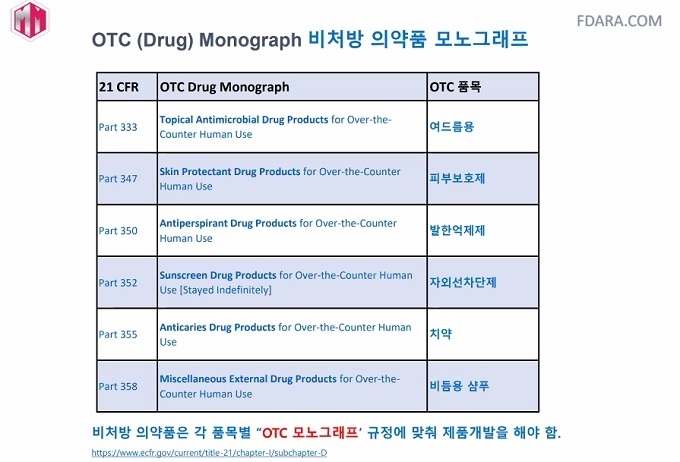
발한억제제, 자외선차단제, 비듬 샴푸, 여드름 제품, 피부보호제(살리실산이 들어간 제품)은 OTC로 분류된다. 미국 시장은 제품 안전에 대해 세부적인 요구조건을 명시하지 않지만, 대신 제조사가 안전성을 보장할 수 있는 화장품을 시장에 출시하도록 요구한다.
2020년 미국은 모노그래프 사용자에게 수수료를 부과하는 법(OMUFA, Over-the-Counter Monograph User Fee Act)을 통과시켰다. 50년 노후된 제도의 새로운 제정을 위해 투자 재원을 확보하고 부족한 인력과 예산, OTC 산업 관리를 위해 5년간 징수한다.
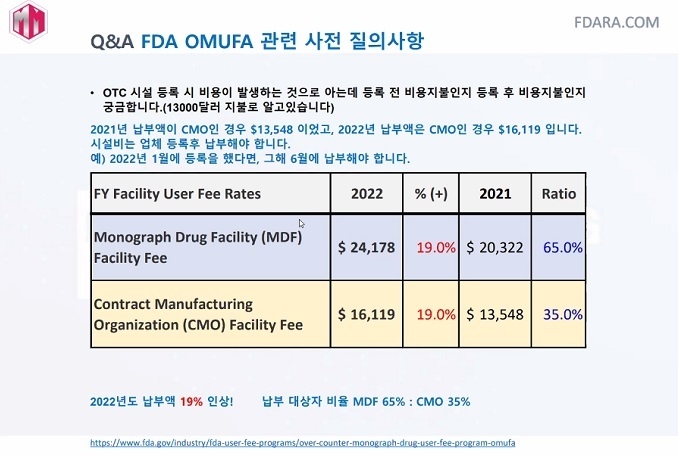
FDA 수수료는 제조사에만 부과된다. 모노그래프에 해당하는 제조사는 MDF(OTC 제조사), CMO(위탁생산자)가 해당되며 등록을 마쳐야 한다. 한 제조사에서 여러 제품 등록이 가능하다. 수수료는 2022년 MDF $24,178, CMO $16,119 이다. 2021년 5월 첫 징수한 이후 2022년에는 6월이 납부기한이다. 만약 납부를 지체했다면 사유를 설명하고 60일내 지불해야 한다.
만일 수수료를 납부하지 않은 업체는 FDA 체납자 리스트에 공개 되고 해당 업체에서 생산되는 OTC 제품은 부정표기로 간주되며 통관이 거부된다. 공장 등록이 되어 있지만 미국에 제품을 수출, 유통한 기록이 없다면 해당 사유서를 제출 후 수수료를 면제받게 된다.
존권 대표는 “매년 10월 1일부터 12월말 사이가 OTC Drug 업체 등록 및 제품 리스팅 갱신기간이다. 갱신기간 동안 삭제(delisting) 처리하면 사용자 수수료는 부과되지 않는다”고 덧붙였다. 만약 제품 유효기간이 만료되더라도 자동적으로 취하가 안되기 때문에 FDA 시스템 안에서 삭제 처리해야 한다. 특히 유통/판매 중단 날짜도 FDA 시스템 안에서 입력이 가능하다. 이때 labeler 검색 사이트에서 뜨는 경우는 연말 갱신기간이 지난 후에 업데이트가 된다. 예를 들어 12/31/2022 로 입력하면 2023년 상반기 안에 데이터가 삭제된다.
한편 OTC Drug에만 허용되는 문구를 화장품 라벨링에 표기하거나, OTC 제품인데 등록을 하지 않게 되면 FDA는 제조사 실사를 하지 않더라도 먼저 Warning Letter(경고 서한)을 FDA 웹사이트에 게재하여 해당 업체에 경고를 하게 된다. 이를 받게 되면 제품 포장, 광고 문구, 웹사이트 등에 사용된 과대표현을 수정해야 한다. ‘Warning Letter’를 받은 제조사 제품은 통관지체(detention) 및 통관 불허(refusal)로 이어질 수 있다.
웨비나 참석자들의 주요 질문을 다음과 같이 소개한다.
Q1. 수수료를 내지 않으면 어떻게 되는가?
A1. 제품 리스트를 삭제 처리하면 수입/유통/판매를 할 수 없다. 또 제품 등록을 취하하고 일반 화장품으로 판매를 하는 경우, 일반 화장품은 OTC제품이 아니므로 시설등록비 납부 대상이 아니다. 다만 화장품 성분이나 효능이 OTC에 해당되면 통관이 불허된다. 또 해외직접 판매 제품은 정식 수입이 아니므로 FDA에서 관여하지 않는다. 향후 새로운 규정이 나올 가능성은 있다.
Q2. 등록시 제조공장 실사가 필수인가?
A2. 실사가 필수는 아니지만 추후 실사 대상에 오를 수 있다. FDA 실사는 △정기 실사 △특별/선별 실사가 있다. 최근 FDA는 여러 사정으로 예전처럼 자체 예산으로 실사를 나오지 않는다. 대신 기업이 실사를 원하는 경우에는 관련 비용을 청구하게 된다.
Q3. 나이아신아마이드와 아데노신이 첨가된 미백 앰플이 있다. 이 경우 OTC 등록이 필수인가?
A3. 나이아신아마이드와 아데노신 성분은 OTC Active Ingredient(활성성분)가 아니므로 OTC 등록이 필수조건이 아니다. 전체 포뮬러를 잘 확인해야 한다.
Q4. 살리실산 성분이 들어간 제품은 무조건 OTC로 분류되나요?
A4. 살리실산 성분이 함유된 품목 카테고리에 따라 제한에 차이가 있다. 비듬용 제품은 1.8~3%, 여드름용 제품은 0.5~2% 이다.
Q5. 제조사 모르게 브랜드사에서 제품 등록을 진행하면서 제조사를 등록할 경우, 면제 사유서를 FDA에 제출하면 제조시설 등록비용이 면제가 되나?
A5. 브랜드사가 제조사와 협의 없이 일방적으로 제품 등록을 진행하면 제조사 등록 비용 면제 사유 신청을 할 수 없다. 면제 사유서는 제조사에서 직접 제출해야 한다.
Q6. 화장품과 OTC제품이 포함된 세트를 판매할 경우 세트 등록을 해야 하는지, 아니면 세트 안의 OTC제품만 OTC 등록해야 하나요?
A6. 세트 상품은 OTC제품만 등록하면 된다. 참고로 세트 상품 및 패키징의 라벨표기는 반드시 OTC Drug 라벨링 규정에 따라 기재해야 한다.