화장품 제조소의 품질경영체계 기준으로 CGMP → ISO 22716으로 일원화가 필요하다는 게 화장품선진화 협의체의 논의 결과다.
CGMP는 국내 화장품 규격 생산 중심의 위험성 관리 및 시설기준에 중점을 두고 있다. 국내 법규 고시기준을 따라야 하며 국내에선 법규 점검 시 이점이 있다.
반면 ISO22716은 해외 화장품 규격 제품 중심의 위험성 관리 및 체계적인 시스템 관리에 초점을 맞춘다. 국내 및 해외 법규를 따른다. 일부 국가에선 수입규제 수단 또는 감사 면제를 받을 수 있다.
우리나라가 정회원으로 가입한 ICCR(화장품 규제조화 협의체)에서는 2008년 국제표준화기구(ISO)의 화장품 GMP 기준을 실행하도록 합의한 바 있다. (ISO 22716:2007 Cosmetics-Good Manufacturing Practices(GMP)-Guidelines on Good Manufacturing Practices)
이 때문에 해외에선 ISO 22716을 글로벌 스탠다드로 받아들여지고 있다. 다만 우리나라만 CGMP와 ISO 22716 모두 권장하고 있다.
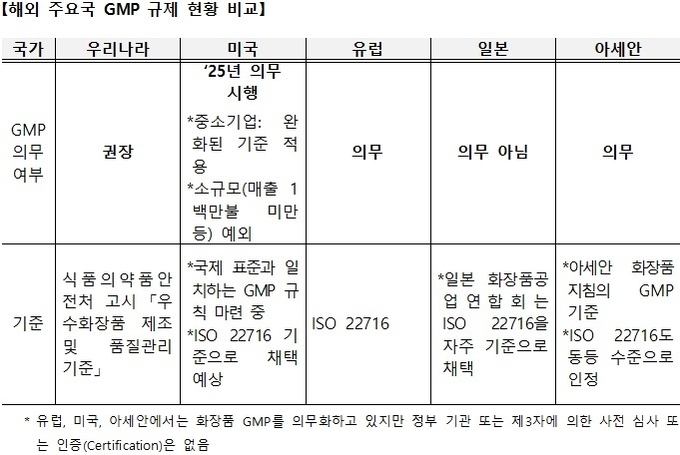
중국의 경우 정부 발행 CGMP 인증서가 있으면 독성시험자료 제출이 면제된다. 이 때문에 프랑스는 ANSM(국립의약품건강제품안전청), 영국 OPPS(제품안전표전사무국)의 위임을 받은 국제무역부(DIT)에서 발급하기도 한다.
이에 대해 협의체 관계자는 “미국이 최근 MoCRA법을 마련하면서 GMP를 ‘25년부터 의무 시행하지만 △중소기업에겐 완화된 기준 적용 △1백만불 이하 소규모 기업 예외 등을 제시하고 있어 주목하고 있다. 그럼에도 미국 화장품협회의 질의 회신에 따르면 ISO 22716 기준으로 채택을 예상, 보편적으로 받아들여지고 있다”고 설명했다.
현재 CGMP 우수화장품 적합업소(전공정, 벌크제조, 충전·포장 포함) 등록업소는 172개(’21) →174개(‘22.09)→161개소('23.02)다. 전공정만 보면148개(’23.02)로 더 이상 증가하지 않고 있다. 최근 5년간 자진취하 또는 폐업, 경기 하락 등 이유로 41개소가 감소한 사실에서 보듯 제조소로선 CGMP 인증을 받기 위해선 시간과 비용 부담도 크지만 사후관리도 만만치 않은 게 현실이다.
협의체 관계자는 “CGMP 인증은 정부의 직접 인증으로 신뢰도가 높을 수 있지만 기업의 규모, 상황을 고려하지 않은 획일적인 GMP 기준으로 현재의 숫자는 전체 제조업체(4427곳)의 3.3%에 불과하다”고 전했다.
실제 화장품 제조업체 설문조사(‘18~'22)에 따르면 국내 CGMP 인증심사 주요 애로사항으로 ①제조소의 규모, 특성 등이 고려되지 않은 규격화된 평가 ②화장품의 특성에 맞지 않는 의약품 GMP 체계에 따른 평가 ③시설 구비, 공기조화시설 설치 등 하드웨어 중심의 평가로 기업 부담 ④단속과 규제가 목적이 아닌 실제 생산을 지원하는 평가시스템 필요 등을 꼽았다.
그동안 식약처, 관련기관, 학계 전문가들이 참여한 규제혁신 민관협의체에서 논의된 결과 ISO 22716을 글로벌 스탠다드로 확인했다. CGMP 대신 ISO 22716으로 일원화할 경우 정부 보증이 아닌 데서 오는 소비자의 신뢰 제기, 기존 CGMP 적합업소의 반발도 있을 수 있다는 걱정도 있다. 품질경영체계의 선택이지, 제품 자체의 품질과는 상관없다고 협의체 관계자는 강조했다. CGMP 인증 제조사의 거의 모두가 ISO 22716 인증을 취득하고 있는 게 현실이다.
특히 화장품 품질경영체계 운용에 있어서 ISO 22716(17개 항목)이 포괄적 경영자 책임을 명시하고 있는데 비해 국내 CGMP(가이드)는 하드웨어 중심이란 점이 비교된다. 때문에 기업책임을 강화한 화장품법 규정 준수로 소비자 신뢰를 얻는 한편 화장품 수출주도 국가인 우리나라 입장에선 ISO 22716으로 일원화해야 한다는 게 다수 의견이라고 협의체 관계자는 전했다.












![[이슈] 미 철강·알루미늄 파생상품 추가 관세 관련 Q & A](http://www.cncnews.co.kr/data/cache/public/photos/20250835/art_17561105403748_9591d1_70x70_c0.jpg)
















