중국의 ‘화장품 등록자료 관리 스케줄’이 확정됐다. 이에 따라 기업들은 관련 규정에 따른 등록업무를 진행해야 한다. 중국 판매계획 일정표를 확정 전에 등록을 마쳐야 마케팅에 차질을 빚지 않게 된다. 특히 2021년 5월 1일부터 구(舊) 플랫폼 신청은 전면 중단된다.
이에 대해 중국 정부의 공식 시험·검역·등록·교육서비스 기관인 씨에이아이큐테스트(CAIQTEST Korea, 检科测试) 김주연 본부장은 “국가약국감독관리국(NMPA)은 5월 1일 ‘화장품허가등록관리방법’ 시행을 앞두고 관련 세칙들을 최종 확정하고 연이어 발표할 것으로 예상된다”며 “신(新) 허가등록플랫폼 신설과 원료사들의 원료신고 요구사항이 예고되어 있음으로 기한 내 대비해야 한다”고 강조했다.
먼저 NMPA는 두 차례 의견수렴 과정을 거쳐 최종 3월 4일 ‘화장품허가등록자료관리규정(이하 자료규정)을 발표했다. 자료규정은 ▲총칙 ▲사용자 ID 및 허가등록 자료 요구사항 ▲변경/연장/취소 등 절차별 요구사항 ▲부칙 등 총 6장 60조로 구성되어 있다.
부칙은 총 24개로△신청표, 정보표, 개요표 등 양식 △경내책임자 수권서, 제품집행표준, 허가연장 자가검사 현황보고서 등 견본 △제품 집행표준 편집, 원료 안전성 정보 신고 등 기술관련 서류의 양식과 지침 등이 있다.
’자료규정‘과 ’관련 사항 공고(과도기 문서)‘에는
①지난 1월 7일 ’관리방법‘ 발표 시 NMPA 新허가등록 플랫폼 신설로 인한 ID신청(화장품, 원료사, 신원료, 치약 카테고리 분류)
②화장품 원료사: 新플랫폼에 기업 및 원료 안전성 정보 제출 후 원료 신고번호 부여(原料报送码)
③화장품 허가/등록인: 모든 성분의 안전성 정보 제출 필요(no. 2 원료 신고번호(原料报送码)보유 시 생략 가능)
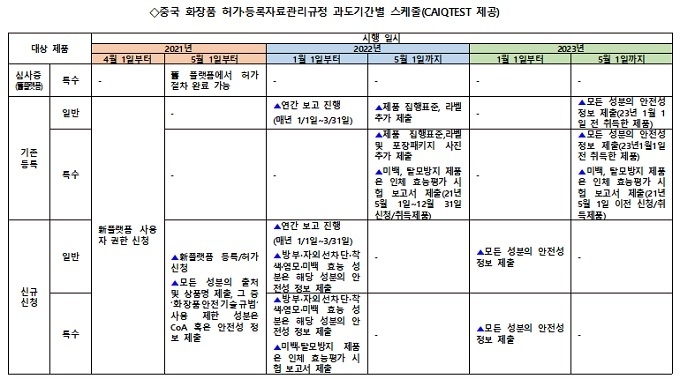
④기 등록한 화장품: 지정 기간 내 ‘성분, 집행표준, 라벨,효능’ 관련자료 보완 필요(아래 표 참조)
⑤일반 화장품: 매년 1월 1일~3월 31일 新플랫폼내 연간 보고 필수(생산, 수입, 법규준수현황등)
⑥특수화장품: 미백·탈모방지제품의 인체효능평가시험보고서 제출 필수 등 사전에 대비해야 할 사항들이 명시되어 있다.
CAIQTEST 김주연 본부장은 “오는 4월 1일부터 新플랫폼 사용자 권한 신청이 시작되며, 5월 1일 기준 신플랫폼에서 신규 신청 진행, 舊플랫폼은 심사 중인 허가절차 완료 예정으로 되어 있다”고 설명했다.
또한 “기존 등록제품과 23년 1월 1일 이전 취득제품의 모든 성분의 안전성 정보가 23년 5월 1일 이전에 제출돼야 한다”고 김 본부장은 덧붙였다.
정리하면 2021년 5월 1일부터 舊 플랫폼에서 신규 신청은 받지 않는다. 다만 그 전에 舊플랫폼을 통해 제출 및 수리되었으나 허가 결정을 내리지 않은 특수화장품 신청사항은 舊허가·등록 플랫폼에서 계속 심사 및 허가를 진행한다.
또 舊허가·등록 플랫폼에서 이미 허가를 취득했거나 등록된 제품은 경내책임자가 2022년 5월 1일 이전에 新플랫폼에 제품 집행표준 및 제품 라벨 원고를 제출하고, 일반화장품(국산=중국산)은 제품 처방을 기입 ❷특수화장품은 판매 포장의 라벨 이미지를 업로드해야 한다.
이밖에 기미제거·미백 및 탈모 방지 화장품의 허가 신청 시 ‘규정에 따라 요구에 부합하는 인체효능시험보고서’를 2022년 1월 1일부터 제출해야 한다. 다만 ▲기 허가 취득한 경우는 2년 경과(2023년 5월 1일 이전에 제출) 전에, ▲2021년 5월 1일~12월 31일 신청해 허가 취득한 경우에는 1년 경과(2022년 5월 1일) 전에 인체효능시험보고서를 각각 보충 제출해야 한다.
한편 경내책임자는 매년 1월 1일~3월 31일 사이에 新플랫폼을 통해 ‘일반 화장품 연간 보고서’를 제출해야 한다.






























