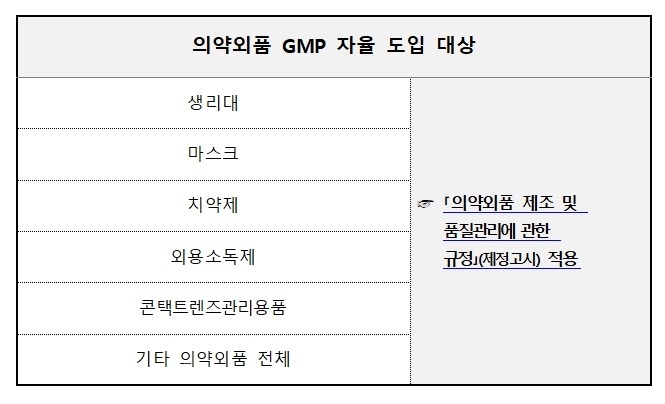
식약처는 생리용품·마스크·콘택트렌즈관리용품 등 의약외품의 제조·품질관리기준(GMP)과 세부 운영방안을 담은 ‘의약외품 제조 및 품질관리에 관한 규정’을 9월 26일 제정·시행한다.
기존 GMP 의무 적용 품목군 외에 의약외품도 GMP를 도입할 수 있게 된 것이다. 다만 의약외품 업계 특성상 소규모 영세업체가 다수인 점을 고려해 GMP 기준 도입을 희망하는 업체 대상으로 자율적으로 추진한다고 밝혔다.
제조사가 관할 지방식약청에 GMP 적합판정을 신청하면 유효기간 3년인 ‘의약외품 제조·품질관리기준(GMP) 적합판정서’를 발급할 계획이다. 적합업체는 ▲ 의약외품 제조·품질관리기준(GMP) 적합 로고 표시·광고 허용 ▲ 정기적 약사감시와 수거‧검사 주기 완화 등의 우대 조치를 받게 된다.
식약처는 앞서 의약외품 제조·품질관리기준(GMP) 시범운영 업체 12개소를 대상으로 모의실사를 수행하는 등 의약외품 제조·품질관리기준(GMP) 도입상황을 점검했다고 소개했다. [생리용품(3개소), 콘택트렌즈관리용품(2개소), 마스크(6개소), 치약제(1개소)]