9일 열린 대한화장품협회 주최 ‘MoCRA 시설등록, 제품리스팅, 라벨링’ 웨비나는 접속자 수가 408명에 질문이 쏟아지는 등 뜨거운 열기로 가득했다. 협회 관계자는 올해 진행 중인 웨비나 가운데 가장 많이 참가했으며 만족도도 4.8점으로 가장 높다고 귀띔했다.
 강사로 나선 엠톰글로벌(MTOM Global) 존권(John Kwon) 대표는 “7월 1일 등록까지 앞으로 50일 남았다. 늦어도 6월 초까지 등록하길 권장한다. 에러나 수정을 고려해 필요할 경우 FDA 담당자에게 직접 문의해서 답을 확인해야 함으로 여유있게 대응해야 한다”고 말했다.
강사로 나선 엠톰글로벌(MTOM Global) 존권(John Kwon) 대표는 “7월 1일 등록까지 앞으로 50일 남았다. 늦어도 6월 초까지 등록하길 권장한다. 에러나 수정을 고려해 필요할 경우 FDA 담당자에게 직접 문의해서 답을 확인해야 함으로 여유있게 대응해야 한다”고 말했다. 또한 미국, 남아프리카공화국, 캐나다 등 여러 국가에서 접속해보니 한국이 속도가 느리거나 끊기는 경우가 발생해 미리 등록할 것을 권했다.
이날 웨비나에서 존권 대표는 시설등록, 제품 리스팅의 로그인 계정 만들기부터 항목 별로 하나씩 체크하며 직접 시연해 실무자들의 관심을 끌었다.
ID는 최소 8개 대문자-소문자-숫자로, Password는 최소 15개 대문자-소문자-숫자-특수기호 포함, Security Question은 최소 4개 글자를 기재해야 한다. 계정 로그인 후 서비스 약관 동의 버튼을 클릭해야 비로소 등록이 가능했다. 화장품 유형 분류, 전성분 표기 등에서 예시를 선택하거나 직접 기재하면 된다고 존권 대표는 설명했다.

항목에 따라 FDA Cosmetic Direct의 회신이 수분 동안 지체되기도 했다. 존권 대표는 “전성분 표기는 까다롭고 시간이 많이 소요될 수 있다”고 말했다. UNII 코드가 없어도 등록엔 상관 없지만 FDA의 권장이란 점에 유의할 필요가 있었다. fragrance의 경우 타사가 신청 승인 받은 것을 사용하면 안된다는 점도 짚어줬다.
제품리스팅 완료 후 옵션은 필수항목은 아니지만 가능하다면 정보 제출을 FDA는 권장하고 있다. 존권 대표는 “코스메틱스 디렉트 포털사이트의 사용시 에러 또는 이슈가 되는 경우는 △ 특수기호 사용 불가능 △ UNII 성분코드 불일치 △ 내부 시스템 오류 등이 있다. 만일 등록이 안되거나 의문이 생길 경우 FDA helpdesk에 질문을 남겨 확인할 것”을 조언했다.

사전 질의와 채팅을 통해 질문이 쇄도했다. 질의 내용은 라벨링, 제품리스팅, 소기업(small business), 수입통관, 안전성입증, 에이전트, 광고 표현 순으로 많았다.
대한화장품협회 김경옥 실장은 “오늘(9일) 협회 공지사항에 4월에 업그레이드 된 FDA의 ➊ COSMETICS DIRECT PRODUCT LISTING Tutorial ➋ FACILITY REGISTRATION Tutorial을 게재했으니 실제 등록 시 참고하기 바란다”라고 전했다. 아울러 “웨비나의 사전 질문과 채팅 내용을 항목별로 별도 정리해 웨비나 참가자에게 고지할 예정이다. 동영상은 대한화장품협회 홈페이지 → 글로벌규제조화지원센터 → 교육자료실에 추후 공지할 것”이라고 밝혔다.

MoCRA 등록을 불과 50일 앞두고 업계에선 많은 에이전트들이 기업 상대 설명을 하면서 일부 혼선이 빚어지는 일도 목격된다. RP가 될 수 없음에도 해줄 수 있다거나, 아직 확정되지 않은 안전성 보고서 작성을 이유로 비용 부담을 요구하기도 한다.
사실 MoCRA는 CPNP, NMPA에 비해 미확정된 상태. FDA가 미국 유통 화장품의 데이터 수집 차원에서 시행하는만큼 처음에는 화장품기업이 직접 등록하면서, 미국 시장을 다시 들여다볼 기회로 삼아야 한다고 업계 전문가들은 말하고 있다.
한편 엠톰글로벌 존권 대표는 새로 FDA가 업그레이드한 시설등록·제품리스팅의 지침서(tutorial)에 따른 시연과 함께 MoCRA 최신 동향도 소개했다.
국내 기업의 질문이 많았던 소규모기업(small business)에 대해서도 미국 및 해외기업 모두 포함된다는 점을 분명히 했다. 3년 동안 미국에서 평균 연간 총 매출이 1백만불 미만이되, 다만 눈의 점막+주사 화장품+24시간 이상 외관 변경 화장품 등은 해당되지 않는다.
RP(책임자)에 대해서도 “공정 포장 및 라벨링 법에 따라 라벨에 표시된 화장품 제조업체, 포장업체, 유통업체” → “국내외 제조업체, 포장업체 또는 유통업체 중 한 업체가 RP 지정. 책임자는 따로 유해사례 보고를 받을 수 있는 (미국 내 주소와 전화번호 또는 전자연락처가 있는) 법인이나 자연인(수입자, 유통업자, FDA u.S. Agent 또는 콜센터 등)을 선임, 지정하고 그 정보를 라벨에 기재해야 한다”고 존권 대표는 상세히 설명했다.

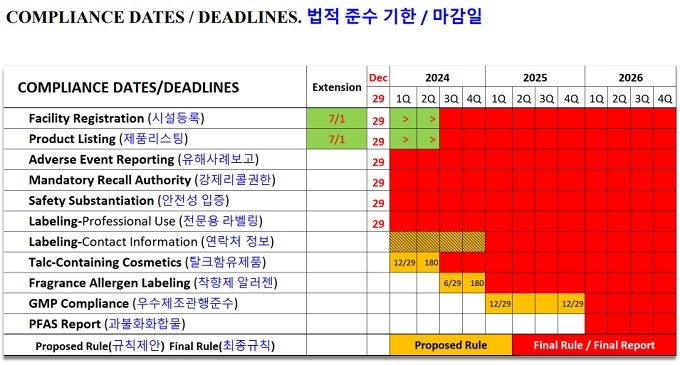
새로 업데이트 된 내용도 소개됐다. 그중 ▲ 시설등록(facility registration): 2년마다 등록 갱신(비용 없음). 기존시설은 2024.07.01.까지 등록, 신규시설은 첫 제조일로부터 60일 이내 또는 기존시설 등록 마감일보터 60일 이내(두 날짜 중 더 늦은 날짜로) ▲ 제품 리스팅(product listing): 1년마다 리스팅 업데이트. 기존 제품은 2024.07.01.까지, 신규 제품은 처음으로 시판되는 경우 미국 주(state) 간 상거래에서 시판 후 120일 이내 등의 시한이 각각 정해졌다.
라벨링(labeling)의 경우 2024년 12월 29일부터 제품리스팅 라벨에 표기된 RP가 부작용 보고를 받을 수 있는 미국 내 주소, 전화번호 또는 전자연락처(이메일 또는 웹사이트 주소) 정보를 기재해야 한다.
추가로 ▲ 유해사례 기록: 책임자는 보고서 6년 동안 유지, 소규모 기업은 3년 ▲ 중대한 유해사례 보고: 책임자는 최초 보고 후 1년 이내 새로운 중요한 의료정보를 보고받은 후 영업일 기준 15일 이내 보고서 제출 ▲ GMP 규정: 제정일로부터 2년 이내(2024.12.29.) 규칙 제안 발표 예정, 3년 이내(2025.12.29.) 최종 규칙 발표 예정 등도 업데이트 됐다.
기록(Records) 보관의 경우 화장품 불량 관련 모든 기록에 접근하고 복사할 수 있도록 허용해야 한다고 규정하고 있다. 그럼에도 레시피, 포뮬러, 재무데이터, 가격, 개인 데이터, 연구 데이터, 판매 데이터 등은 해당되지 않는다는 점도 명확히 했다. 이는 기업 비밀 관련 FDA가 NMPA와 현저히 다른 점이다.
또한 월마트(Walmart)가 제품리스팅 정보를 요구하고 있는 사실에서 대부분의 유통채널에서 이를 채택할 가능성이 커졌다.